题目背景
最近,我们的wjd王先生被一道高中的水解平衡题目的离子含量定性比较给难住了,在下觉得解答的过程很精妙,于是在此做出此题的解答。
题目描述
王先生喜欢中和反应。他左手有一瓶pH=2的HAc(CH3COOH)溶液,右手有一瓶pH=12的NaOH溶液,且这两瓶溶液体积相同。
王先生喜欢变魔术,于是他把两瓶溶液倒在了一起。他想知道,此时溶液中各离子的含量大小关系,请你来帮他一下。
解答
酸碱性
显然,这是个水解平衡问题,如果是强酸强碱中和,那么pH应当为7,显中性,但是醋酸是弱酸,为了表现出pH=2,它需要比pH=2的盐酸溶液更高的HAc浓度。
也就是说,如果是盐酸,而这反应完毕后就是一锅汤NaCl溶液,显中性,但是此时弱酸过量,也就是说反应后$c(H^+)>c(OH^-)$。
过量的醋酸根
随后,我们发现NaOH和HAc的反应是这样的:
$NaOH+HAc==NaAc+H_2O$
也就是说,现在溶液中有多少$Na^+$,就有多少的$HAc$发生了中和反应。从上文可以知道还有一部分没发生反应的HAc会电离出$Ac^-$,所以溶液中$c(Ac^-)>c(Na^+)$。
阳离子浓度比较
最麻烦的问题来了:如何比较$c(Na^+)$和$c(H^+)$的大小?
这就需要一定的数学推导了(思路来自数竞大佬kjy)
首先写下电离方程式:
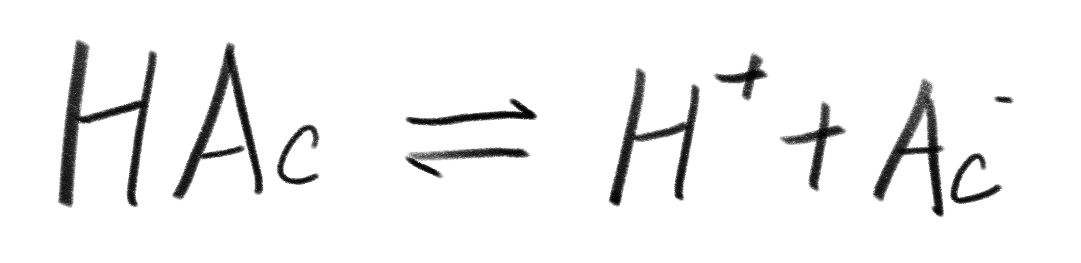
然后我们此处已知氢离子浓度/pH,但是我们假装不知道,假设混合之前,在wjd手上的那瓶HAc中,HAc的浓度是x,$H^+$和$Ac^-$的浓度都是y。
所以我们可以得到醋酸的电离平衡常数:
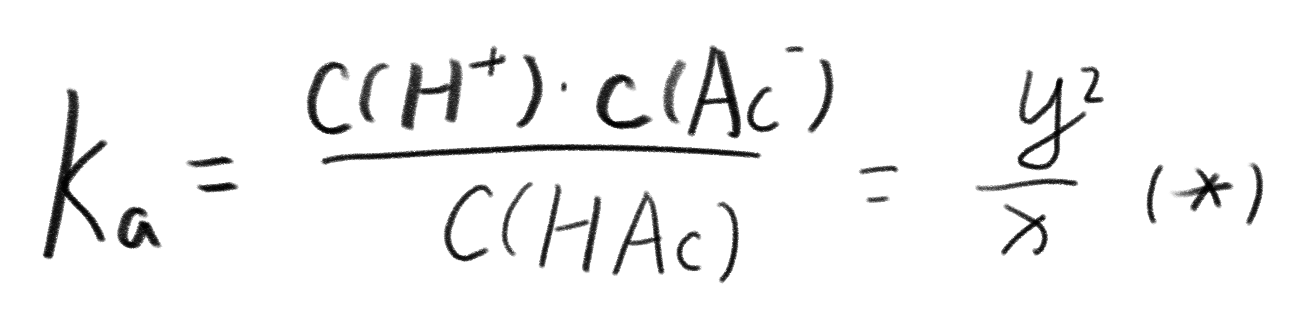
继续,我们按照步骤把溶液中和,此时HAc过量,上述的电离仍然在进行,由于温度并没有发生改变,$K_a$仍然不变。
但是在等体积的两种溶液混合后,不考虑生成的水,所有溶质的浓度都要折半,而氢离子被完全消耗,即:
$$\left{\begin{matrix}c(HAc)=\frac{x}{2}\c(H^+)=0\c(Ac^-)=\frac{y}{2}\end{matrix}\right.$$
那么我们假设有$\omega$浓度的HAc被转化,写出三段式:
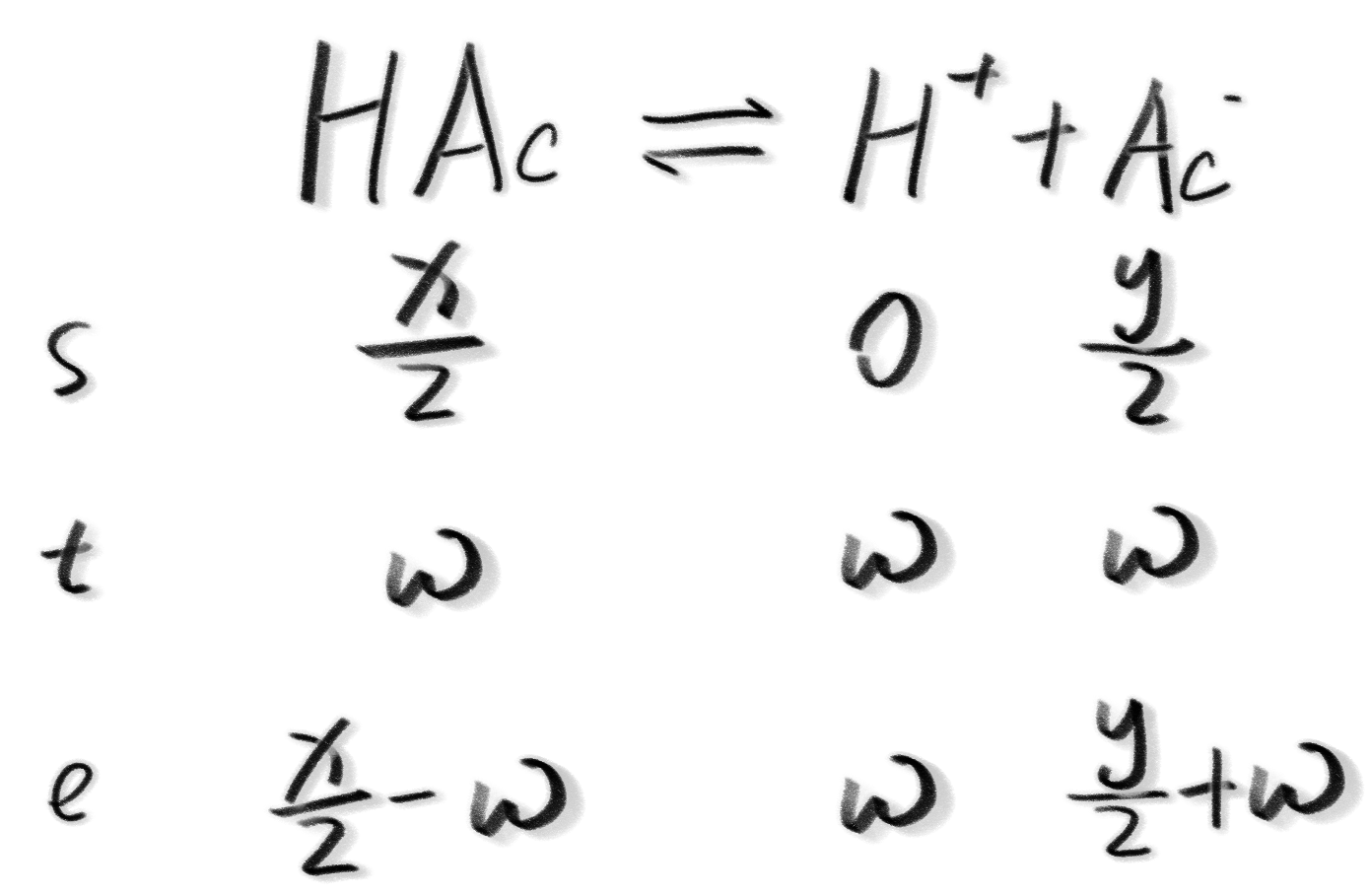
那么由于$K_a$没有发生变化,我们可以得到关系式:
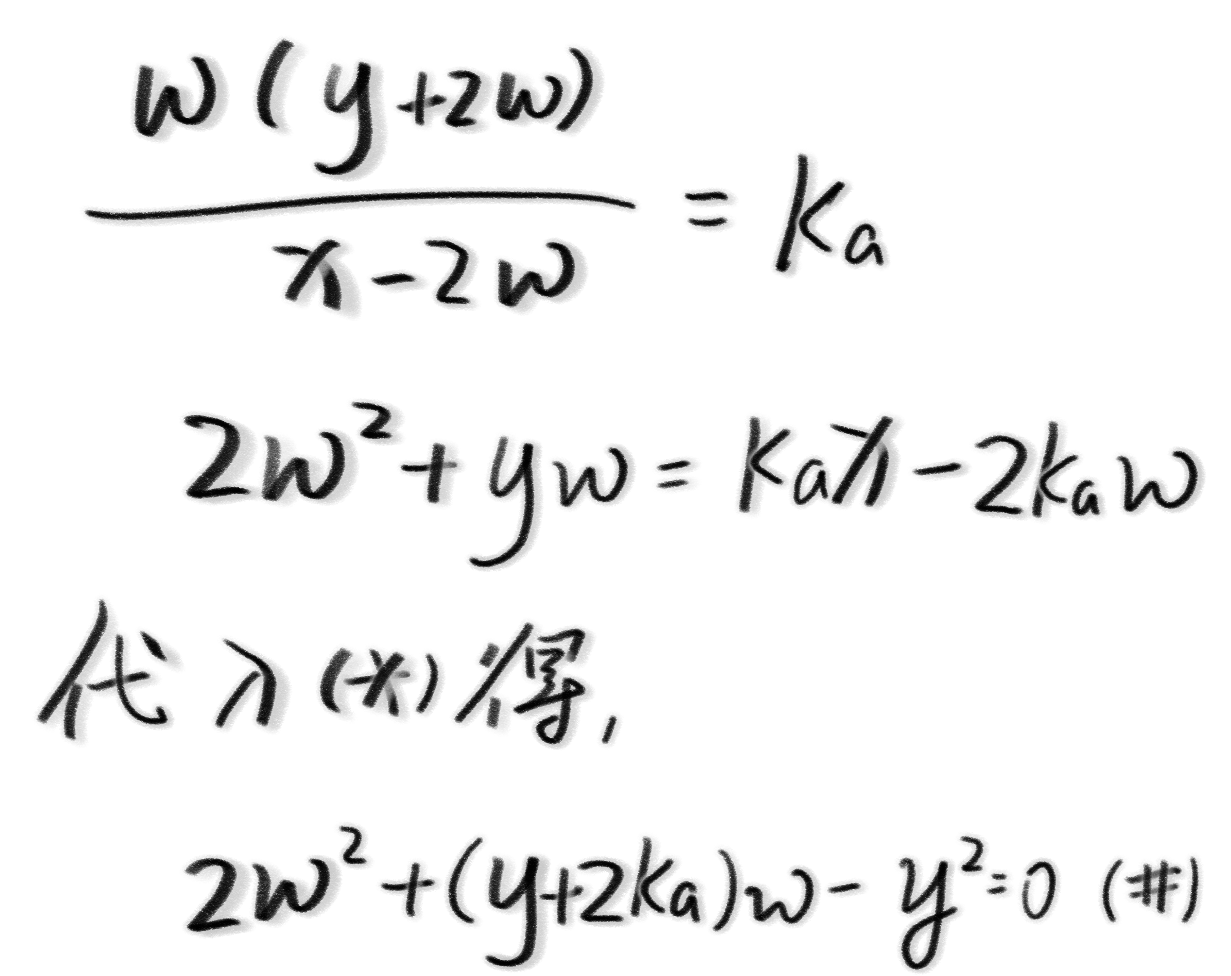
那么我们来分步解方程,首先是$\Delta$。
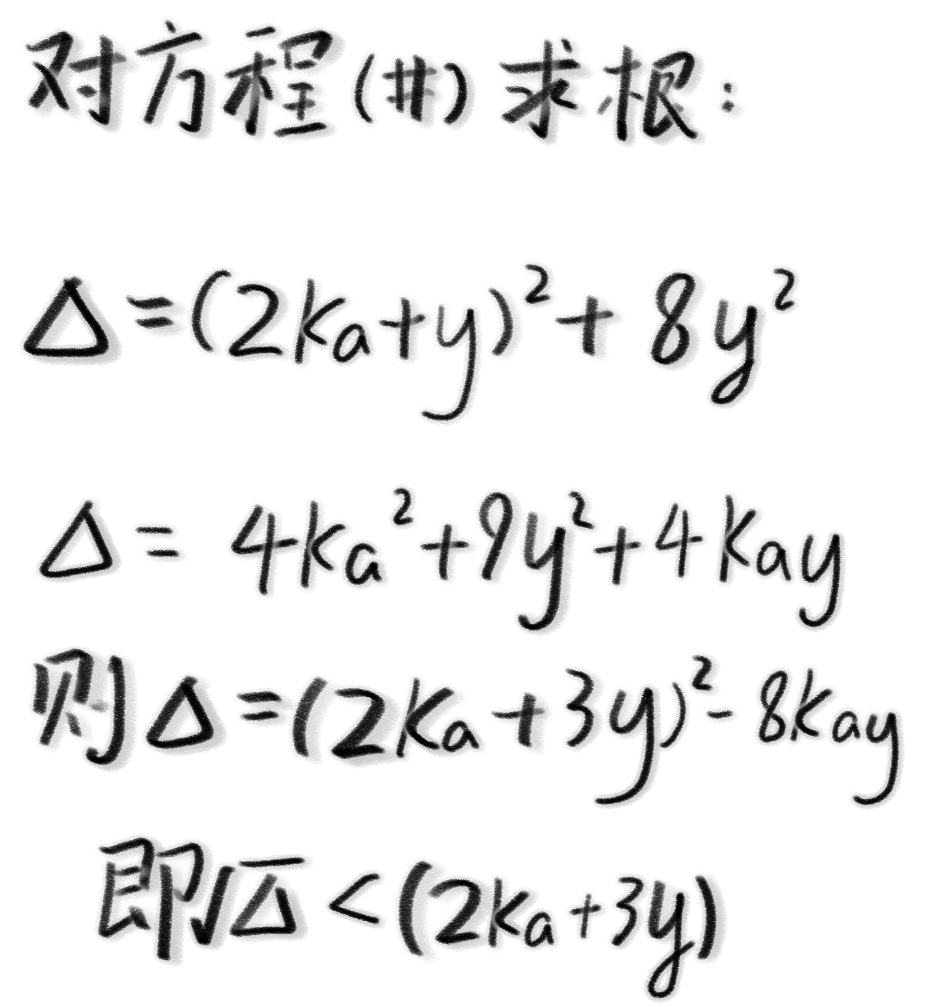
发现$\Delta$有一步奇妙的一次放缩机会,仿佛……求根公式中可以抵消掉一点什么!
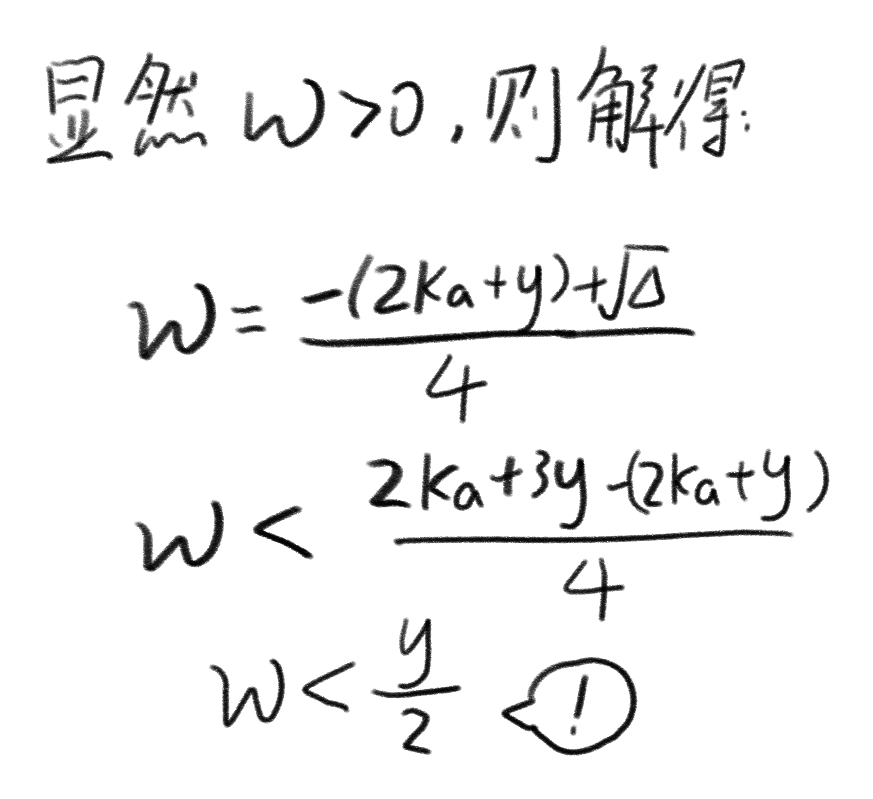
回头看一眼$\frac{y}{2}$的含义?竟然是$\large\text{钠离子浓度!}$
因为此时的氢离子全部被转化而来,所以$\omega$就是$\large\text{氢离子浓度!}$
所以我们得到了结论:
$$\huge c(Na^+)>c(H^+)$$
最后,我们进行一次完整的排序:
$$\Large c(Ac^-)>c(Na^+)>c(H^+)>c(OH^-)$$
得到最终答案。
后记
简而言之,要定性分析离子浓度并不麻烦,只要能把握住平衡常数这样的不变量进行混合前混合后的分析,加之解方程求解范围即可,此题比较特殊,是一个恒成立现象。
你发现了吗?在忽略水的电离的条件下,其实pH对$c(Na^+)$和$c(H^+)$的大小关系并无影响,所以只要保证混合前二者pH不接近于pH=7,上述的关系就一定存在啦~
By first_fan
2019.12.10